近日,我中心崔一平、王著元教授课题组在外泌体光学检测领域取得新进展,研究成果先后在ACS Nano、Small、Biosensors & Bioelectronics、Nanoscale等国际知名期刊发表,引起国际同行的重视。
外泌体是一种包含复杂RNA和蛋白质纳米囊泡,其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中,参与细胞间通讯等生理活动。外泌体广泛存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中,可作为一种潜在生物标志物。检测外泌体对于疾病的早期筛查和预后监测等方面具有重要意义。针对外泌体检测及其生物意义识别,本课题组开发了多种新型光学传感基底、检测技术和分析方法。
早在2016年,崔一平、王著元课题组在国际上率先提出使用有标表面增强拉曼光谱(SERS)技术检测外泌体,开发了一种基于免疫三明治结构的癌细胞外泌体检测方法。(Anal. Methods, 2016,8, 5001-5008)随后,又引入多元探针和On-Off传感原理,利用磁性底物特异性筛选待测血液中的外泌体,实现了多种类外泌体的同时高灵敏检测,检测限低至73个/μL,并成功应用于真实血液样本的外泌体检测。研究成果以“Screening and Multiple Detection of Cancer Exosomes Using an SERS-Based Method”为题发表在国际期刊Nanoscale上,该论文入选Web of Sci高被引论文,获得领域内广泛关注。(Nanoscale, 2018,10, 9053-9062)

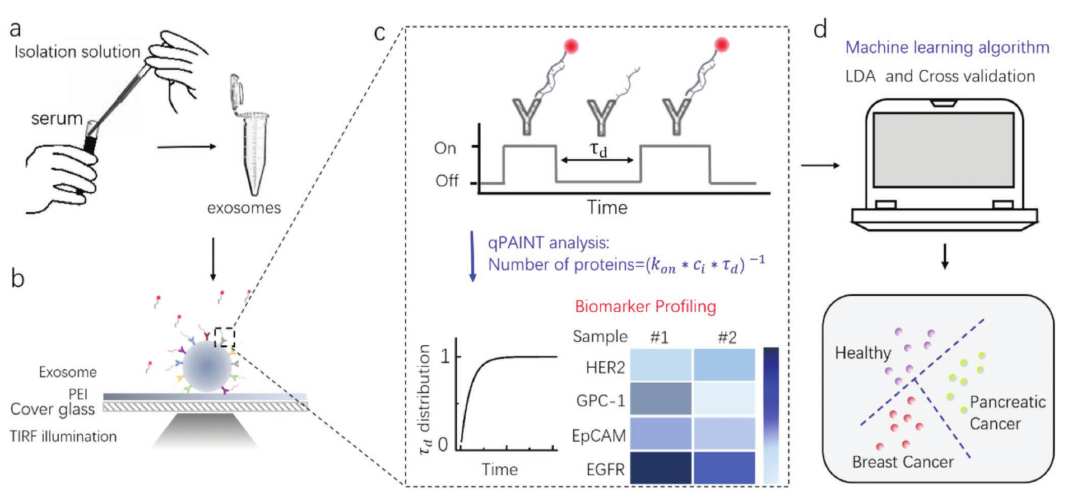
研究大量外泌体的宏观表达可以解析样本整体的生理信息,而对单个外泌体水平的检测可以探究外泌体的异质性,提高诊断的准确性和特异性。课题组开发了一种基于DNA-PAINT技术和机器学习算法的定量分析平台,在单个外泌体水平上实现对多个外泌体表面生物标志物的定量分析,同时鉴定了四种外泌体表面生物标志物(HER2,GPC-1,EpCAM,EGFR)的表达图谱。进一步地,该平台被应用于临床血液样本中癌症相关外泌体的检测,并被用于未知样本中胰腺癌和乳腺癌的预测,准确率达到100%。相关成果以“Profiling of Exosomal Biomarkers for Accurate Cancer Identification: Combining DNA-PAINT with Machine-Learning-Based Classification”为题发表在国际期刊Small上。(Small, 2019, 15, 1901014)
为了降低外泌体检测中非特异性结合对检测结果可靠性的影响,课题组制备了一种基于疏水组装纳米橡子的表面增强拉曼散射(SERS)传感器。传感器结构中的疏水基底由纳米球阵列上六边形填充金膜构成,不再需要传统生物传感器中采用的繁琐的非特异性封闭过程,显著减少了非特异性吸附。另一方面,SERS探针的有序分布保证了良好的重复性,样本相对标准偏差<7%。利用该平台,可实现对外泌体膜蛋白HER2,EpCAM,CD63的全血分析。(ACS Appl. Mater. Interfaces2020, 12, 26, 29917–29927)
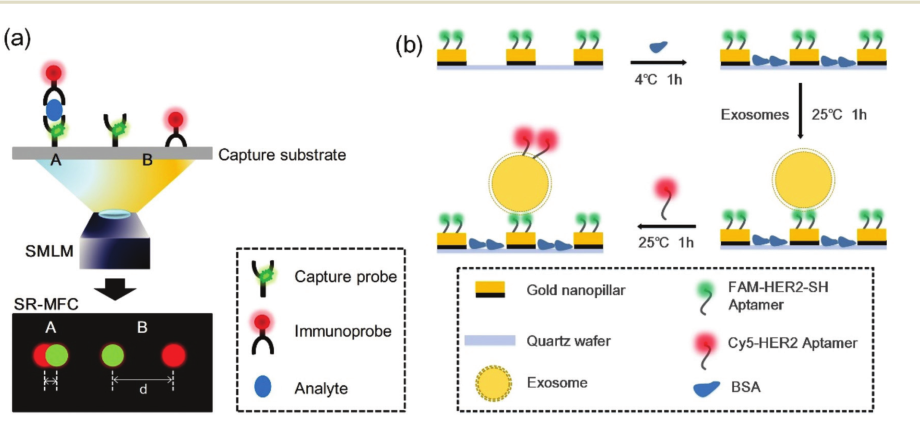
另外,在光学超分辨率成像方面,课题组还提出了一种通用有效的免疫分析策略来降低非特异性吸附的影响,即超分辨率多色荧光共定位(SR-MFC)。它可以产生较低的假阳性率。利用单分子定位显微镜(SMLM)的高空间分辨率,首次实现了非特异性的反应位点的可视化和剔除,从而消除了非特异吸附的影响。与普通免疫荧光法相比,该平台对外泌体的检测结果的准确性和可靠性大大提高。外泌体的检测限为38个/μL。该方法还可以推广到其他生物标志物(例如蛋白质、DNA等)的检测,是免疫诊断的重要新策略。该研究成果以“Eliminating Nonspecific Binding Sites for Highly Reliable Immunoassay via Super-Resolution Multicolorfluorescence Colocalization”为题发表在Nanoscale上。(Nanoscale, 2021,13, 6624-6634)
上述研究受到国家优秀青年科学基金(No. 61822503)等资助。
